- „SOLIDARNI Z UKRAINĄ” – projekt Narodowej Agencji Wymiany Akademickiej
- Projekty aktualne
- Projekty finansowane lub dofinansowane z budżetu państwa lub z państwowych funduszy celowych
- Projekty archiwalne
- Usługi
- Administracja
- RODO
- Rada Naukowa
- Struktura
- Pracownicy
- Studia Doktoranckie
- Erasmus +
- Biblioteka
- Wydawnictwa
- Zamówienia Publiczne
- Piszą o Nas
- EURO-LABS
- Central European Initiative Project (CEI)
- CERAD
Informacje o 14 Międzynarodowym Kongresie Badań Radiacyjnych (ICRR 2011), Warszawa, 28.08.2011 – 1.09.2011
W dniach od 28 sierpnia do 1 września 2011 roku odbył się w Pałacu Kultury i Nauki w Warszawie 14 Międzynarodowy Kongres Badań Radiacyjnych (14th International Congress of Radiation Research (ICRR 2011)) organizowany przez Polskie Towarzystwo Badań Radiacyjnych imienia Marii Skłodowskiej-Curie pod auspicjami Polskiej Prezydencji w Unii Europejskiej i Ministerstwa Gospodarki. W ramach kongresu odbyło się coroczne spotkanie Radiation Research Society – międzynarodowej organizacji zrzeszającej naukowców zajmujących się badaniami radiacyjnymi.
Czternasty Kongres ICRR po raz pierwszy odbył się w Polsce. Nie jest to przypadek, tylko hołd oddany przez naukowców z całego świata naszej słynnej rodaczce, Marii Skłodowskiej-Curie. W roku 2011 przypada stulecie otrzymania przez Nią jej drugiej Nagrody Nobla z chemii za wydzielenie i scharakteryzowanie nowych pierwiastków promieniotwórczych, radu i polonu. Rok 2011 jest obchodzony w Polsce jako Rok Marii Skłodowskiej-Curie i w całym kraju odbywają się liczne wydarzenia, spotkania, konferencje dotyczące Jej osoby. Na Kongresie ICRR w Warszawie mieliśmy przyjemność słuchać przygotowanego przez wnuczkę Marii Skłodowskiej-Curie, panią Helene Langevin-Jolliot, interesującego wykładu o jej babce. W ostatniej chwili okazało się, że pani Langevin-Jolliot nie może przyjechać; nie odebrała zatem osobiście przyznanego jej przez Polskie Towarzystwo Badań Radiacyjnych medalu imienia Marii Skłodowskiej-Curie.
Tegoroczny 14 Kongres ICRR w Warszawie zgromadził ponad 1000 naukowców z całego świata. Prawdopodobnie był to największy kongres naukowy odbywający się w tym roku w Polsce. Program naukowy Kongresu obejmował wszystkie dziedziny nauki zajmujące się współcześnie badaniami radiacyjnymi: fizykę, chemię, biologię, medycynę i ochronę radiologiczną. Jednocześnie z Kongresem odbyły się 4 sympozja satelitarne w: Krakowie, Pradze, Kijowie i Jülich (Niemcy). Spotkanie w Krakowie przebiegało pod hasłem "Science as a public duty - following the ideas and work of Maria Skłodowska-Curie". Prezentowane były tematy dotyczące trendów w diagnostyce naczyniowo-sercowej i jej wpływu na zdrowie kobiet, fizycznych i biologicznych podstaw hadronoterapii (terapii ciężkimi jonami) oraz społecznych i kulturowych wpływów na zdrowie kobiet. Sympozjum w Pradze podejmowało tematy dotyczące etycznych aspektów wpływu środowiska na zdrowie publiczne („Ethics of Environmental Health”). Sympozjum w Kijowie dotyczyło zdrowotnych i środowiskowych efektów katastrofy w Czarnobylu z perspektywy ćwierci wieku później. Natomiast w Jülich tematem przewodnim były fizyczne, komórkowe i medyczne aspekty efektu Augera (zjawisko emisji elektronów przez atom, zachodzące dzięki energii uwolnionej na skutek wypełniania luk w niskich powłokach elektronowych przez elektrony z wyższych powłok).
W Warszawie z powodu ogromnej liczby uczestników i poruszanych tematów wystąpienia ustne podzielono na 6 równoległych sesji. Odbyło się również ponad 700 prezentacji plakatowych podzielonych na 41 sesji. Nie sposób było jednocześnie uczestniczyć we wszystkich sesjach i obejrzeć wszystkie plakaty. Każdy z uczestników musiał dokonać własnego wyboru i nie będzie truizmem stwierdzenie, że każdy znalazł coś dla siebie. Przeglądając tytuły sesji ustnych i plakatowych można było stwierdzić przewagę tematów biologicznych i medycznych. Obradowano również na temat ochrony radiologicznej, biodozymetrii i chemii radiacyjnej. Poruszano tematy efektów awarii elektrowni atomowych w Czarnobylu oraz Fukushimie-Daiichi oraz terroryzmu jądrowego. Osobną sesję poświęcono naukom radiacyjnym w kontekście elektrowni jądrowych.
To krótkie streszczenie pokazuje, że nauki radiacyjne to bardzo szerokie spektrum wiedzy. Wiedza ta jest często interdyscyplinarna: z pogranicza biologii, medycyny, chemii, fizyki i matematyki. Dotyka szeregu bardzo ważnych dla społeczeństwa dziedzin takich jak: diagnostyka medyczna, leczenie nowotworów, energetyka jądrowa, ochrona przed promieniowaniem, nanotechnologie. Chciałbym hasłowo zasygnalizować państwu szereg tematów podejmowanych obecnie przez radiobiologię, przedstawianych i dyskutowanych oczywiście na 14 Międzynarodowym Kongresie Badań Radiacyjnych w Warszawie. Wybór tematów będzie subiektywny i z racji mojego wykształcenia skupię się na szeroko rozumianej radiobiologii.
Promieniowanie a nowotwory
Nie od dzisiaj wiadomo, że promieniowanie jonizujące jest jednym z czynników najefektywniej wywołującym nowotwory. Według klasycznej nomenklatury skutki działania promieniowania na poziomie organizmu dzielimy na deterministyczne i stochastyczne. Skutki deterministyczne są rezultatem umierania komórek w promieniowrażliwych narządach, takich jak szpik kostny, czy wyściółka jelita cienkiego. W szpiku kostnym giną komórki macierzyste odpowiedzialne za produkcję morfotycznych elementów krwi: erytrocytów, białych krwinek i płytek. Powoduje to ogólne osłabienie organizmu, spadek liczby limfocytów we krwi, co skutkuje obniżeniem odporności, a później pojawia się niedokrwistość i niekiedy - skaza krwotoczna. Umieranie komórek nabłonka jelita cienkiego na skutek popromiennej programowanej śmierci komórek (apoptozy) prowadzi do utraty bariery wodno-elektrolitycznej w jelitach i w konsekwencji do utraty elektrolitów, pojawienia się obrzęków i owrzodzeń, a także infekcji jelit. Skutki deterministyczne są zależne od dawki zarówno pod względem częstości jak i nasilenia objawów. Można dla nich wyznaczyć wartość progową, poniżej której nie wystąpią.
Stochastyczne skutki promieniowania zależą od dawki tylko wtedy, gdy chodzi o prawdopodobieństwo ich wystąpienia. Nasilenie objawów i przebieg choroby nie są zależne od wielkości dawki otrzymanej. Głównym i najbardziej śmiercionośnym stochastycznym skutkiem promieniowania są choroby nowotworowe. Oprócz nich wymienia się choroby serca i oczu. Charakterystyczną cechą stochastycznych skutków promieniowania jest długi dystans czasowy od napromienienia do wystąpienia objawów. Szacuje się, że popromienne białaczki pojawiają się w kilka lat od napromienienia, natomiast nowotwory lite jeszcze później. Co ciekawe, wykrywając nowotwór, na podstawie jego wyglądu i rodzaju nie można powiedzieć nic na tematy przyczyn jego powstania u danej osoby. Na przykład, jeżeli ktoś całe życie palił papierosy i wykryto u niego nowotwór płuc, nie można twierdzić, że był on spowodowany paleniem, bo jego powód mógł być całkiem inny. Można natomiast stwierdzić na podstawie badań epidemiologicznych, że palenie powoduje w danej populacji powstawanie nowotworów z określonym prawdopodobieństwem.
Na kongresie temat zależności pomiędzy promieniowaniem a powstawaniem nowotworów omawiany były w różnych aspektach, poczynając od znanego paradoksu, że wprawdzie promieniowanie powoduje indukcję nowotworów, ale to samo promieniowanie jest w tej chwili powszechnie używane do leczenia nowotworów. W swoim wykładzie „The two two-edged swords” David Brenner z Uniwersytetu Kolumbia (Stany Zjednoczone) porównał ten paradoks do dwóch mieczy z dwoma ostrzami [1]. To samo porównanie zostało użyte do opisania sytuacji współgrania dwóch dziedzin nauki, radiobiologii i fizyki, w zakresie charakterystyki niskich dawek promieniowania i ich wpływu na nowotworzenie oraz użycia wysokich dawek promieniowania przy terapii. Według prelegenta, fizyka coraz lepiej opisuje to, co się dzieje w naszych organizmach po niskich dawkach promieniowania, które wywołują kancerogenezę, natomiast w dziedzinie radioterapii coraz większą rolę odgrywa biologia. W leczeniu nowotworów postęp w używaniu nowych metod radioterapii w ciągu ostatnich kilkudziesięciu lat był imponujący. Zaczęło się od promieniowania gama z radu, kobaltu czy cezu, potem była era promieniowania X i super-nowoczesnych aparatów do IMRT (terapia z modulacją intensywności dawki); kolejnym etapem było napromienianie neutronami, protonami, ciężkimi jonami czy mezonami. Każda z kolejnych, proponowanych form radioterapii była w istotny sposób lepsza – bardziej zabijała komórki nowotworowe, bardziej oszczędzała otaczające tkanki. Rozwijało się również planowanie terapii. Jednak w ostatnich latach wydaje się, że osiągnięto pewną granicę – schematy planowania terapii są już na tyle doskonałe, że ich dalsza znaczna poprawa nie wydaje się już możliwa, nie ma pomysłów na dokładniejsze deponowanie energii w obrębie nowotworu, niż to się dzieje przy terapii jonami (Ryc. 1). Natomiast - i to było również widać na kongresie - opracowuje się coraz więcej zindywidualizowanych terapii wykorzystujących metody i odkrycia biologii molekularnej: radiofarmaceutyki związane z nośnikami biologicznymi deponujące dawkę dokładnie w nowotworze, leki zmieniające mikrośrodowisko komórek nowotworowych, zaburzające sygnalizację procesów naprawy DNA, czy w różny sposób uwrażliwiające komórki nowotworowe na radioterapię. Nie wszyscy zgadzają się z tezą o stopniowym przesunięciu środka ciężkości w onkologii z fizyki na biologię i na ten temat odbyła się debata pomiędzy profesorem Maciejewskim, wieloletnim dyrektorem Centrum Onkologii w Gliwicach, a profesorem Bentzenem z Uniwersytetu Wisconsin [2].
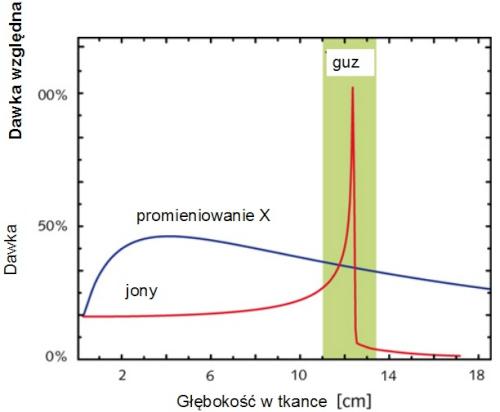
Ryc. 1. Rozkład dawki promieniowania w tkance. Napromienienie jonami pozwala zdeponować „większość” dawki na niewielkim obszarze w obrębie guza, nie uszkadzając otaczających tkanek. Takiego efektu nie uzyska się, stosując promieniowanie X czy gamma.
W ostatnich latach radiobiolodzy coraz więcej uwagi poświęcali tzw. niecelowanym efektom działania promieniowania jonizującego (non-targeted effects of ionising radiation). Na kongresie w Warszawie grupa badaczy biorąca udział w projekcie NOTE (NOn-Targeted Effects of ionising radiation - finansowanym przez UE) zaproponowała zmianę klasycznego paradygmatu radiobiologii, przyjmującego, że głównym „celem” („tarczą”) działania promieniowania w komórkach jest DNA i tam powstają uszkodzenia, które manifestują się w ciągu jednej lub dwóch generacji komórek i mogą prowadzić do powstania nowotworu [3] (ryc. 2). Uważają oni, że takie założenie nie tłumaczy wszystkich efektów działania promieniowania, a w szczególności procesu powstawania popromiennych nowotworów i należałoby również uwzględnić ważne, szczególnie przy małych dawkach „niecelowane” („non-targeted”) efekty, takie jak efekt sąsiedztwa (widza), niestabilność genetyczną, odpowiedź adaptacyjna oraz nadwrażliwość na małe dawki promieniowania. Najbardziej rozpoznawalnym z „niecelowanych” efektów promieniowania jest efekt sąsiedztwa (widza – bystander effect). W skrócie polega on na tym, że komórki bezpośrednio uszkodzone przez promieniowanie „komunikują” się z nieuszkodzonymi komórkami w ich sąsiedztwie i część z tych komórek również zostaje uszkodzona (ryc. 3). Są liczne doniesienia o obserwacji tego efektu in vivo czyli w żywych organizmach (ryc. 4).
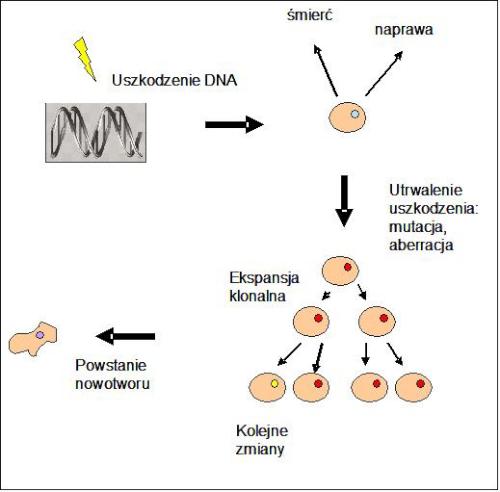
Ryc. 2. Klasyczny schemat indukcji nowotworu przez promieniowanie. Promieniowanie uszkadza DNA w komórce. Komórka albo umiera, albo naprawia uszkodzenie, albo błędnie naprawia uszkodzenie, co skutkuje zmianą genetyczna: mutacją albo aberracją. Uszkodzona komórka dzieli się i komórki potomne po wielu kolejnych zmianach mogą stać się komórkami nowotworowymi.

Ryc. 3. Klasyczny eksperyment obrazujący efekt sąsiedztwa: napromieniamy szalkę z komórkami, pożywkę znad napromienionych komórek przenosimy do szalki z nienapromienionymi komórkami, obserwujemy efekty w nienapromienionych komórkach – komórkowy (indukcję apoptozy, zmniejszenie przeżywalności w wyniku innych typów śmierci komórkowej) i/lub genetyczny (mutacje, aberracje chromosomowe, mikrojądra) [4].
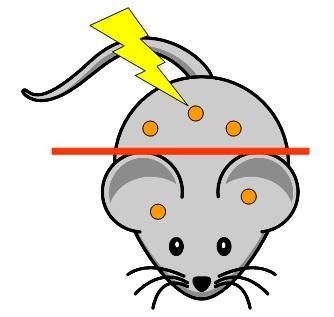
Ryc. 4. Eksperyment pokazujący efekt sąsiedztwa in vivo: połowa myszy została napromieniona, co indukowało nowotwory, nie tylko w napromienionej tylnej części ciała, ale również w nienapromienionej przedniej połowie ciała [5].
Wiele sesji poświęconych było kolejnym aspektom indukcji lub leczenia nowotworów. Bardzo dużo miejsca poświęcono wspomnianym już wcześniej wpływom niskich dawek promieniowania na powstawanie raka. Omawiano wpływ niedotlenowania komórek nowotworowych na ich zwiększoną radiooporność i sposoby przeciwdziałania temu uodpornieniu. Proponuje się w tym przypadku użycie wraz z radioterapią szeregu leków stymulujących rozwój naczyń krwionośnych w obrębie guza [6]. Inną analizowaną strategią była próba blokowania usuwania kwasu mlekowego z komórek rakowych poprzez wyciszenie genu mct-4, odpowiedzialnego za produkcję białka – transportera kwasu mlekowego, przy użyciu specjalnie skonstruowanego si-RNA [7] (ryc. 5). To podejście opiera się na obserwacji, że niedotlenowane komórki nowotworowe muszą korzystać z innego procesu pozyskiwania energii niż tlenowy i jest to tzw. glikoliza (ta sama zresztą, która jest nasilona w niedotlenowanych mięśniach po ostrym treningu, wywołując „zakwas"), której rezultatem jest energia, ale i toksyczny dla komórek kwas mlekowy.
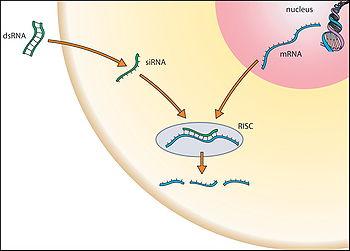
Ryc. 5. Mechanizm wyciszania genów poprzez działanie si-RNA. Krótki si-RNA (mały interferujący RNA) wiąże się z kompleksem białkowym RISC i komplementarnym mRNA. Argonauta – jedno z białek wchodzących w skład kompleksu RISC - przecina mRNA, uniemożliwiając jego translację. Dzięki temu zostaje „wyłączony” gen, z którego transkrybowane jest ten konkretny mRNA (R. Robinson 2004 – źródło rysunku – Wikipedia) [8]. Potencjalnie terapia si-RNA może być skuteczna w wielu chorobach, np. raku, chorobie Parkinsona, cukrzycy, chorobach nerek i wielu innych.
Przedstawiono przeciwstawne opinie na temat czy napromienienie guza nowotworowego zwiększa migrację komórek nowotworowych i przez to liczbę przerzutów. Dyskutowano o stymulującym wpływie radioterapii na system immunologiczny, co daje ciekawe perspektywy nowych strategii leczniczych. Rozważano korzyści z kombinowanej terapii nowotworowej promieniowaniem, hipotermią i chemioterapią. Zwrócono uwagę na problem nowotworów wtórnych po radioterapii. Problem ten narasta, bo coraz efektywniej leczy się choroby nowotworowe, coraz więcej osób wygrywa walkę z chorobą i może potem żyć jeszcze przez wiele lat. U takich właśnie osób, jak również u dzieci, terapeutyczne dawki promieniowania mogą przyczynić się do powstania nowych ognisk rakowych w wiele lat po zakończeniu terapii. Przedstawiono argumenty przemawiające za mechanizmem epigenetycznym powstawania takich nowotworów (na przykład w wyniku trwałej zmiany ekspresji genów poprzez mechanizm wyciszenia transkrypcji).
Nowe trendy w dozymetrii biologicznej
Kolejną dziedziną szeroko omawianą na 14 Międzynarodowym Kongres Badań Radiacyjnych była dozymetria biologiczna: procedury pozwalające na podstawie zmian w organizmie „odczytać” dawkę promieniowania, na jaką narażona była dana osoba. Najczęściej analizuje się zmiany w limfocytach krwi obwodowej, takie jak częstość chromosomów dicentrycznych lub mikrojąder, a także poziom ufosforylowanej postaci histonu gamma-H2AX (ryc. 6).
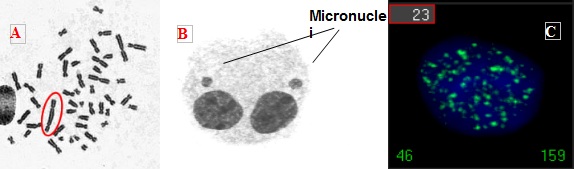
Ryc. 6. Zmiany popromienne w limfocytach ludzkich, będące podstawą dozymetrii biologicznej. Zdjęcia mikroskopowe: panel A – chromosom dicentryczny (Zdjęcie mitozy, kiedy DNA w jądrze jest najbardziej skondensowany i widoczne są poszczególne chromosomy. Nieuszkodzony chromosom ma 1 centromer (widoczny jako przewężenie), podczas gdy uszkodzone przez promieniowanie chromosomy mogą mieć więcej centromerów.); panel B – mikrojądra (Zdjęcie limfocytu w drugiej fazie G0 po napromienieniu. Widoczne 2 jądra komórkowe, które uzyskuje się poprzez blokowanie podziału cytoplazmy po podziale jądra i 2 mniejsze od jąder mikrojądra, zawierające uszkodzony materiał genetyczny.); panel C – ogniska histonu gamma-H2AX (widoczne jądro limfocytu w 1 godzinę po napromienieniu i zielone ogniska histonu gamma-H2AX wyznakowane immunofluorescencyjnie).
W ostatnich latach zmieniło się podejście do dozymetrii biologicznej. Szczególny nacisk kładzie się teraz na możliwość szybkiej analizy limfocytów pochodzących od wielu osób, nawet kosztem dokładności oznaczenia dawki (klasyczna dozymetria biologiczna jest czaso- i pracochłonna). Wykorzystuje się do tego zautomatyzowane mikroskopy połączone z systemami do analizy obrazu, co pozwala przynajmniej częściowo usprawnić analizę dicentryków, mikrojąder, lub histonu gamma H2AX w tzw. ogniskach naprawy (ryc. 7).

Ryc. 7. Automatyczny mikroskop Zeiss z systemem do analizy obrazu Metasystems (Niemcy), wykorzystywany do dozymetrii biologicznej w Instytucie Chemii i Techniki Jądrowej w Warszawie.
Kolejną możliwością przeprowadzenia dozymetrii biologicznej u wielu osób jest bliska współpraca laboratoriów na poziomie krajowym lub międzynarodowym. Gwarantuje ona, że przy zdarzeniu radiacyjnym o masowej skali, materiał do analizy będzie jednocześnie analizowany w kilku laboratoriach. Wychodząc naprzeciw potrzebie dostosowania dotychczas używanych metod dozymetrycznych, jak i zorganizowania współpracy laboratoriów, w połowie 2010 roku rozpoczął się międzynarodowy projekt MULTIBIODOSE, finansowany częściowo z środków Unii Europejskiej. W projekcie uczestniczy 13 laboratoriów z 10 krajów, w tym z Polski. Pierwsze wyniki projektu były prezentowane na konferencji w Warszawie w trakcie 2 wystąpień: profesora Huberta Thierensa z Belgii o automatyzacji procesu liczenia mikrojąder i doktor Alicji Jaworskiej z Norwegii, która przedstawiła ogólne założenia projektu [9, 10].
Ten krótki, subiektywny przegląd tematów poruszanych na 14 Międzynarodowym Kongresie Badań Radiacyjnych powstał w wyniku uczestnictwa autora w powyższym kongresie; księga abstraktów dostępna jest on-line pod linkiem: http://www.icrr2011.org/pliki/files/icrr_program_complete_2011_08_23.pdf
Odsyłacze:
- Exploring the Two Two-Edged Swords, David Brenner, Center for Radiological Research, Columbia University, USA, Failla award lecture, ICRR, Warsaw 2011;
- Debata Kongresowa: This house believes that further advances in radiation oncology will come from physics rather than from radiation biology, B. Maciejewski – dyrektor Centrum Onkologii w Gliwicach, S. Bentzen – z Uniwersytetu Wisconsin, USA, ICRR, Warsaw 2011;
- Highlights of the NOTE program 2006-2010, Sisko Salomaa, STUK – Radiation and Nuclear Safety Authority, Helsinki, Finland, ICRR, Warsaw 2011;
- Survival of human epithelial cells irradiated with cobalt 60 as microcolonies or single cells. C. Mothersill, C. Seymour, Int. J. Radiat. Biol. 1997, Nov; 72(5): 597-606;
- Is Radiation-Induced Non-Targeted Response Relevant to Human Health, T. Hei, Columbia University Medical Center, Center for Radiological Research, USA, ICRR, Warsaw 2011;
- Manipulating the tumor microenvironment in combined modality therapy. G. McKenna, E. Fokas, N. Qayum, J.H. Im, C. Kelly, J.M. Brady, R.J. Muschel, Gray Institute, Oxford University, UK, ICRR, Warsaw 2011;
- Targeting tumor metabolism to improve the outcome of radiotherapy, I Stratford, University of Manchester, UK, ICRR, Warsaw 2011;
- RNAi Therapeutics: How Likely, How Soon, R. Robinson, “PLOS Biol”. 2(1), ss. E28, 2004;
- The automated micronucleus assay as a reliable biodosimetric tool for population triage in large scale radiation accidents, H. Thierens1, A. Vral1, H. Romm2, U. Oestreicher2, S. Barnard3, K. Rothkamm3, E. Ainsbury3, S. Sommer4, C. Beinke5, A. Wojcik6, 1: University Ghent, Belgium, 2: Bundesamt fur Strahlenschutz, Germany, 3: Health Protection Agency, UK, 4: Institute of Nuclear Chemistry and Technology, Poland, 5: Institut fur Radiobiologie der Bundeswehr, Germany, 6: Stockholm University, Sweden; ICRR, Warsaw, 2011;
- MULTIBIODOSE: multi-disciplinary biodosimetric tools to manage high scale radiological casualties, A. Jaworska1, H. Romm2, U. Oestreicher2, H. Thierens3, A. Vral3, K. Rothkamm4, E. Ainsbury4, M. Bendertitter5, P. Voisin5, P. Fattibene7, C. Lindholm7, F. Barquinero8, S. Sommer9, K. Woda10, H. Scherthan11, C. Beinke11, B. Vojnovic12, F. Trompier13, A. Bajinskis14, A. Wojcik14, 1: Norwegian Radiation Protection Authority, Norway, 2: Bundesamt fur Strahlenschutz, Germany, 3: University Ghent, Belgium, 4: Health Protection Agency, UK, 5: IRSN, France, 6: ISS Italy, 7: STUK, Finland, 8: UAB, Spain, 9: Institute of Nuclear Chemistry and Technology, Poland, 10: HMGU, Germany, 11: UULM, Germany, 12: UOXF, UK, 13: EURADOS, 14: Stockholm University, Sweden; ICRR, Warsaw, 2011;
Sylwester Sommer, Centrum Radiobiologii i Dozymetrii Biologicznej Instytutu Chemii i Techniki Jądrowej w Warszawie




